Traitement
de l'eau |
|
Chimie
de l'eau - - - - - - - - - - |
|
La molécule d'eau
|
Qualité de l'eau
La qualité de l'eau utilisée joue un rôle déterminant dans la qualité de lavage et pour la durée de vie des matériels. Dans l'idéal, elle sera :
- Filtrée en amont, pour éviter tout passage d'impuretés pouvant détériorer le matériel de nettoyage
- Décalcairisée partiellement
Elle peut également être :
- Eau de mer : possible avec une pompe adéquate et une bonne filtration à l'arrivée
- Osmosée: utilisée dans les carwash en fin d'opération de lavage
- Recyclée : cela nécessite un choix spécifique de produits détergents (ne doivent pas être moussants) et cela exclut l'osmose.
Le pH (potentiel hydrogène)
|
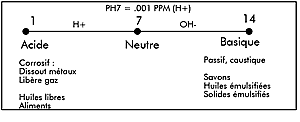 |
|
|
Le Th (dureté de l'eau, charge en calcaire)
La dureté
de l'eau provient de la présence de cations bivalents
Elle varie de 0 à 50 : très douce (<3), douce
(3 à 15), dure (15 à 30), très dure (>30)
Une eau trop chargée de calcaire va provoquer des tâches
sur les supports et abîmer les joints des matériels.
Mais une eau trop dure (pure) va agresser le matériel et le support
à nettoyer.
Elle se mesure en °F dureté (1°F dureté = 10 mg/l
de CaCO3)
Moyens de décalcairisation :
- Élimination
du calcaire :
- Par un adoucisseur placé en amont
- Par un détartrage effectué en atelier avec un produit spécialisé (détartrant passivant)
- Dissolution
du calcaire
- Met en suspension le calcaire pendant l'utilisation de l'appareil, mais lors de l'arrêt de l'appareil le calcaire restant dans les circuits se redépose
- Par un injecteur de produit anti-tartre (sur la plupart des nettoyeurs)
- Par une cartouche de polyphosphates
Alcalinité de l'eau
Capacité
de l'eau à maintenir un pH constant.
Taux d'alcalinité, mesuré en m.éq/l: faible (0,5),
faible-moyen (0,5 à 2), moyen-fort (2 à 5), fort (> 5)
Une eau alcaline peut neutraliser en partie un acide en maintenant ±
son pH
Augmentation de l'alcalinité(pollution) par : phosphates, carbonates,
bicarbonates, hydroxydes, silicates
ORP
Potentiel
d'Oxydation Réduction
La meilleure méthode de mesure des niveaux de contrôle de
bactéries
L'ORP préfère un pH bas
Les nettoyants chimiques élèvent le pH
Quand le pH augmente, le niveau d'ORP baisse
Les tests de chlore libre sont inefficaces à un pH Ú 9,5
Hypochlorous Acid (HOCL) contre Hypochlorite Ion
HOCL
est le choix chimique de contrôle des bactéries
Un pH de 6,8 est recommandé
HOCL devient le chlore libre dominant avec un pH bas
Sodium hypochlorite a un pH de 13,5
 |
||